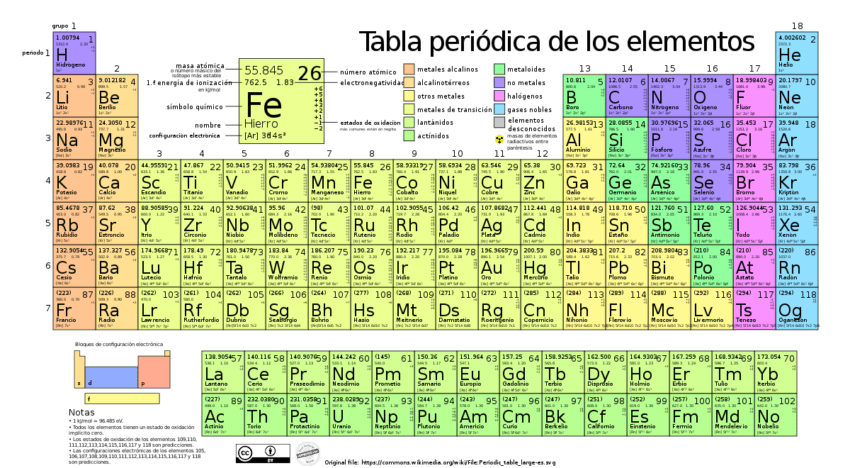
✅ La tabla periódica tiene 7 periodos, cada uno representando una fila horizontal que indica el nivel de energía principal de los electrones.
En la tabla periódica de los elementos químicos, existen un total de siete periodos. Cada uno de estos periodos representa una fila horizontal en la tabla y agrupa a los elementos que tienen el mismo número de capas de electrones. Es decir, el número de periodo de un elemento químico indica el nivel energético más externo que contiene electrones en un átomo en estado fundamental.
Para entender mejor la distribución de los elementos en la tabla periódica, es importante conocer la estructura y características de cada periodo. A continuación, se detalla información relevante sobre cada uno de los siete periodos:
Distribución de los Periodos en la Tabla Periódica
La organización de los elementos en la tabla periódica sigue un patrón específico basado en sus propiedades químicas y físicas. Cada periodo contiene un número determinado de elementos que aumenta a medida que se avanza de arriba hacia abajo en la tabla:
Periodo 1
- Contiene 2 elementos: Hidrógeno (H) y Helio (He).
- Se caracteriza por tener una única capa de electrones.
Periodo 2
- Contiene 8 elementos: Litio (Li), Berilio (Be), Boro (B), Carbono (C), Nitrógeno (N), Oxígeno (O), Flúor (F) y Neón (Ne).
- Los elementos de este periodo tienen dos capas de electrones.
Periodo 3
- Contiene 8 elementos: Sodio (Na), Magnesio (Mg), Aluminio (Al), Silicio (Si), Fósforo (P), Azufre (S), Cloro (Cl) y Argón (Ar).
- Los elementos de este periodo tienen tres capas de electrones.
Periodo 4
- Contiene 18 elementos: Del Potasio (K) al Kriptón (Kr).
- Aquí comienzan a aparecer los elementos de transición.
Periodo 5
- Contiene 18 elementos: Del Rubidio (Rb) al Xenón (Xe).
- Similar al periodo 4, incluye elementos de transición.
Periodo 6
- Contiene 32 elementos: Del Cesio (Cs) al Radón (Rn).
- Incluye los lantánidos (del Lantano (La) al Lutecio (Lu)) que se suelen representar aparte.
Periodo 7
- Contiene 32 elementos: Del Francio (Fr) al Oganesón (Og).
- Incluye los actínidos (del Actinio (Ac) al Lawrencio (Lr)) que también se representan aparte.
Los periodos de la tabla periódica no solo reflejan el número de capas de electrones, sino también un patrón de propiedades químicas y físicas que se repite en cada fila. Esta organización sistemática facilita el estudio y la comprensión de las características de los elementos químicos.
Descripción de los siete periodos en la tabla periódica
La tabla periódica está organizada en siete periodos, cada uno de los cuales corresponde a una fila horizontal. Estos periodos representan el número de capas electrónicas que tienen los átomos de los elementos en ese periodo. A continuación, se describe cada uno de los siete periodos:
Periodo 1
El primer periodo es el más corto, con solo dos elementos: hidrógeno (H) y helio (He). Estos elementos tienen su única capa electrónica completa con 1 y 2 electrones, respectivamente.
Periodo 2
El segundo periodo contiene ocho elementos: desde litio (Li) hasta neón (Ne). Estos elementos completan su segunda capa electrónica, que puede contener hasta 8 electrones.
Periodo 3
Similar al segundo, el tercer periodo también tiene ocho elementos, comenzando con sodio (Na) y terminando en argón (Ar). Los elementos de este periodo llenan su tercera capa electrónica.
Periodo 4
El cuarto periodo es más largo, con 18 elementos, desde potasio (K) hasta cripton (Kr). Este periodo introduce los metales de transición, que llenan los orbitales d.
- Metales de transición: Escandio (Sc) a Zinc (Zn)
- Elementos representativos: Galio (Ga) a Kripton (Kr)
Periodo 5
El quinto periodo también tiene 18 elementos, desde rubidio (Rb) hasta xenón (Xe). Este periodo sigue un patrón similar al cuarto, con elementos que llenan los orbitales 5s, 4d y 5p.
Periodo 6
El sexto periodo es aún más largo, con 32 elementos, incluyendo los lantánidos. Este periodo va desde cesio (Cs) hasta radón (Rn). Aquí se llenan los orbitales 6s, 4f, 5d y 6p.
Ejemplo de Lantánidos
- Lantano (La)
- Cerio (Ce)
Periodo 7
Finalmente, el séptimo periodo también contiene 32 elementos, desde francio (Fr) hasta los elementos superpesados. Este periodo incluye los actínidos y es el único que aún está siendo completado con el descubrimiento de nuevos elementos.
Datos Curiosos:
- El elemento más pesado conocido es el Oganesón (Og), con número atómico 118.
- Los actínidos incluyen elementos como uranio (U) y plutonio (Pu), esenciales en la energía nuclear.
Evolución histórica de los periodos en la tabla periódica
La tabla periódica de los elementos ha evolucionado significativamente desde sus inicios en el siglo XIX. El concepto de periodos en la tabla periódica se ha desarrollado a lo largo de los años a medida que los científicos han descubierto más elementos y han comprendido mejor sus propiedades químicas y físicas.
Primeras versiones de la tabla periódica
En 1869, el químico ruso Dmitri Mendeléyev presentó una versión de la tabla periódica que organizaba los elementos en orden creciente de sus masas atómicas. Aunque esta tabla inicial solo tenía unos 60 elementos, Mendeléyev dejó espacios vacíos para elementos que aún no se habían descubierto, prediciendo correctamente sus propiedades.
Descubrimiento del concepto de periodos
Con el tiempo, los científicos comenzaron a notar que los elementos exhibían una repetición periódica de propiedades. Este patrón llevó a la identificación de periodos en la tabla periódica. Cada periodo representa una fila horizontal en la tabla y contiene elementos cuyos átomos tienen el mismo número de niveles de energía.
Tabla comparativa de periodos y niveles de energía
| Periodo | Número de niveles de energía | Ejemplos de elementos |
|---|---|---|
| 1 | 1 | Hidrógeno (H), Helio (He) |
| 2 | 2 | Litio (Li), Berilio (Be), Boro (B) |
| 3 | 3 | Sodio (Na), Magnesio (Mg), Aluminio (Al) |
Contribuciones clave al desarrollo de la tabla periódica
El desarrollo de la tabla periódica no fue obra de un solo científico. Muchos investigadores contribuyeron con sus descubrimientos y teorías:
- Henry Moseley: En 1913, este físico británico estableció que el número atómico (y no la masa atómica) debería ser la base para organizar los elementos, lo que corrigió ciertas anomalías en la tabla de Mendeléyev.
- Glenn T. Seaborg: En el siglo XX, Seaborg reconfiguró la tabla periódica para incluir los actínidos y lantánidos, creando la disposición moderna que usamos hoy en día.
Impacto de los descubrimientos modernos
En la actualidad, la tabla periódica cuenta con 7 periodos y 118 elementos confirmados. El descubrimiento de elementos transuránicos (elementos con un número atómico mayor que el uranio) ha llevado a una expansión continua de la tabla. Estos elementos son generalmente sintetizados en laboratorios y tienen vidas medias muy cortas.
Recomendaciones para estudiantes
Para aquellos que se inician en el estudio de la química, es fundamental entender la organización de la tabla periódica y el concepto de periodos. Aquí algunos consejos prácticos:
- Memoriza los elementos clave de cada periodo para facilitar el aprendizaje de sus propiedades químicas.
- Utiliza recursos visuales como tablas periódicas interactivas para explorar las relaciones entre los elementos.
- Realiza ejercicios prácticos que involucren la identificación de elementos según su posición en la tabla periódica.
El estudio de la evolución histórica de la tabla periódica no solo brinda una comprensión profunda de la química, sino que también destaca el ingenio humano en la búsqueda del conocimiento científico.
Preguntas frecuentes
¿Qué es la tabla periódica?
La tabla periódica es una organización de los elementos químicos basada en sus propiedades y características.
¿Cuántos periodos tiene la tabla periódica?
La tabla periódica tiene 7 periodos en total.
¿Qué elementos se encuentran en el primer periodo de la tabla periódica?
En el primer periodo de la tabla periódica se encuentran los elementos hidrógeno y helio.
¿Qué indica el periodo de un elemento en la tabla periódica?
El periodo de un elemento indica el número de capas electrónicas que tiene el átomo del elemento.
¿Por qué se llaman periodos en la tabla periódica?
Se llaman periodos porque se repiten de forma periódica las propiedades de los elementos en cada fila de la tabla.
¿Qué información nos proporciona la posición de un elemento en la tabla periódica?
La posición de un elemento en la tabla periódica nos proporciona información sobre su configuración electrónica y sus propiedades químicas.
- La tabla periódica se organiza en 7 periodos.
- Cada periodo representa una fila horizontal en la tabla.
- Los elementos de un mismo periodo tienen el mismo número de capas electrónicas.
- Los elementos de un mismo periodo comparten propiedades químicas similares.
- Los periodos van del 1 al 7 de arriba hacia abajo en la tabla periódica.
¡Déjanos tus comentarios y no olvides revisar otros artículos relacionados con la química en nuestra web!