✅ El comportamiento químico de compuestos con doble enlace entre carbonos es altamente reactivo, permitiendo adiciones y reacciones de polimerización.
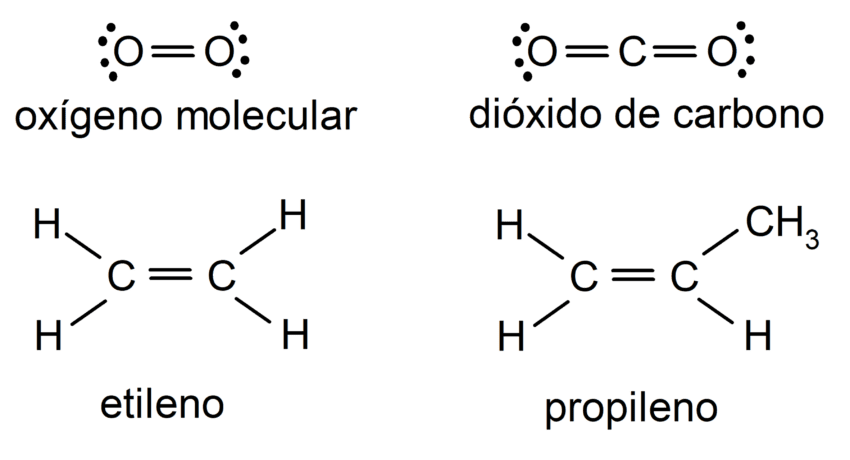
El comportamiento químico de los compuestos con doble enlace entre carbonos, conocidos como alquenos, se caracteriza por su mayor reactividad en comparación con los alcanos debido a la presencia del enlace pi (π). Este enlace pi se encuentra por encima y por debajo del plano del enlace sigma (σ) entre los dos átomos de carbono, lo que lo hace más fácil de romper y, por lo tanto, más reactivo.
Exploraremos en detalle cómo esta estructura influye en las propiedades y reacciones químicas de los alquenos. Analizaremos las reacciones típicas que experimentan, como la adición electrofílica, la polimerización y la oxidación. También discutiremos la importancia industrial de estos compuestos y su presencia en productos cotidianos.
Estructura y Reactividad de los Alquenos
Los alquenos son hidrocarburos insaturados que contienen al menos un doble enlace carbono-carbono (C=C). La estructura del doble enlace se compone de un enlace sigma fuerte y un enlace pi más débil. Esta configuración hace que los alquenos sean más reactivos que los alcanos, que solo tienen enlaces sigma.
Reacciones de Adición Electrofilica
Una de las reacciones más características de los alquenos es la adición electrofílica. En esta reacción, un electrófilo (una especie química que acepta electrones) se añade al doble enlace, rompiendo el enlace pi. Ejemplos comunes de reacciones de adición incluyen:
- Hidrogenación: Adición de hidrógeno (H2) para formar alcanos.
- Hidrohalogenación: Adición de haluros de hidrógeno (HX) para formar halogenuros de alquilo.
- Hidratación: Adición de agua (H2O) en presencia de un ácido para formar alcoholes.
Polimerización
La polimerización es otra reacción importante de los alquenos, en la que múltiples monómeros de alqueno se unen para formar polímeros. Este proceso es fundamental en la industria para la producción de materiales plásticos como el polietileno y el polipropileno.
Oxidación de Alquenos
Los alquenos también pueden oxidarse para formar diferentes productos químicos. Por ejemplo, la oxidación suave puede producir glicoles (dioles), mientras que la oxidación más severa puede romper el doble enlace y producir cetonas o ácidos carboxílicos.
Importancia Industrial de los Alquenos
Los alquenos son extremadamente importantes en la industria química. Se utilizan como materia prima para la síntesis de una amplia gama de productos, incluidos plásticos, detergentes, y productos farmacéuticos. Su reactividad y versatilidad los hacen indispensables en la producción industrial.
Reactividad de los alquenos en reacciones de adición
Los alquenos, también conocidos como olefinas, son compuestos orgánicos que contienen al menos un doble enlace entre átomos de carbono. Este doble enlace aporta una gran reactividad a los alquenos, especialmente en reacciones de adición, debido a la alta densidad electrónica presente en el doble enlace.
Tipos de Reacciones de Adición
Las reacciones de adición en alquenos son variadas y pueden clasificarse en diferentes tipos dependiendo de los reactivos involucrados:
- Adición Electrofílica: Es la más común y ocurre cuando un electrófilo se añade a la molécula de alqueno. Un ejemplo clásico es la adición de halógenos (como Br2 o Cl2), donde el doble enlace se rompe y los halógenos se añaden a los carbonos previamente unidos por el doble enlace.
- Adición Nucleofílica: Menos común que la anterior, en esta reacción un nucleófilo se añade al alqueno. Un ejemplo es la hidroboración, donde el boro actúa como nucleófilo.
- Adición Radicalaria: Ocurre en presencia de radicales libres. Un ejemplo es la adición de HBr en presencia de peróxidos, donde se forma un radical bromo que inicia la reacción.
Mecanismo de la Adición Electrofílica
La adición electrofílica es un proceso en dos etapas que involucra la formación de un carbocatión intermediario:
- El electrófilo se une al doble enlace, formando un carbocatión. Este paso es crucial ya que la estabilidad del carbocatión intermediario determina la velocidad de la reacción.
- Un nucleófilo se une al carbocatión, completando la adición. La reacción se completa con la formación de un producto adicionado.
Ejemplo: Adición de HBr
En la adición de HBr a un alqueno, el H+ (proton) se une primero al doble enlace, formando un carbocatión. Luego, el Br– (bromuro) se añade al carbocatión, resultando en un producto bromado.
La regla de Markovnikov es fundamental en estas reacciones, indicando que el protón (H+) se añade al carbono del doble enlace que tiene más hidrógenos, mientras que el haluro se añade al carbono con menos hidrógenos.
| Reactivo | Producto | Condiciones |
|---|---|---|
| CH2=CH2 + HBr | CH3-CH2-Br | Presencia de HBr |
| CH3-CH=CH2 + HBr | CH3-CHBr-CH3 | Regla de Markovnikov |
Un dato interesante es que el uso de peróxidos puede alterar la orientación de la adición, llevando a la adición anti-Markovnikov, donde el bromo se añade al carbono con más hidrógenos.
Importancia Industrial
Las reacciones de adición de alquenos tienen una enorme relevancia industrial. Por ejemplo, la producción de polietileno, uno de los polímeros más comunes, se basa en la polimerización de etileno (un alqueno simple). Además, muchas otras sustancias químicas importantes, como el etanol y los plásticos, se producen a través de reacciones de adición de alquenos.
Consejo práctico: Al trabajar con reacciones de adición, es crucial controlar las condiciones de reacción, como la temperatura y la presencia de catalizadores, para optimizar el rendimiento y la selectividad de los productos.
Isomería cis-trans en compuestos con dobles enlaces
La isomería cis-trans, también conocida como isomería geométrica, es un fenómeno común en los compuestos con dobles enlaces. Este tipo de isomería se presenta debido a la restricción de rotación alrededor del doble enlace carbono-carbono (C=C).
Concepto y Definición
En la isomería cis-trans, los isómeros se diferencian en la disposición espacial de sus átomos o grupos funcionales en torno al doble enlace:
- Cis: Los grupos funcionales o átomos se encuentran en el mismo lado del doble enlace.
- Trans: Los grupos funcionales o átomos se encuentran en lados opuestos del doble enlace.
Ejemplos de Isómeros Cis-Trans
Un ejemplo clásico de isomería cis-trans se puede observar en el 2-buteno:
- Cis-2-buteno: Ambos grupos metilo (CH3) están en el mismo lado del doble enlace.
- Trans-2-buteno: Los grupos metilo (CH3) están en lados opuestos del doble enlace.
Este comportamiento afecta significativamente las propiedades físicas y químicas de los compuestos. Por ejemplo, el punto de ebullición y el punto de fusión de los isómeros cis y trans pueden ser muy diferentes debido a la variación en la polaridad y la forma de las moléculas.
Propiedades Físicas
Para ilustrar las diferencias en propiedades físicas, consideremos el 2-buteno:
| Isómero | Punto de Ebullición (°C) | Punto de Fusión (°C) |
|---|---|---|
| Cis-2-buteno | 3.7 | -138.9 |
| Trans-2-buteno | 1.0 | -105.8 |
Como se puede observar, el cis-2-buteno tiene un punto de ebullición más alto y un punto de fusión más bajo comparado con el trans-2-buteno. Esto se debe a que las moléculas cis presentan un momento dipolar mayor, lo que provoca interacciones intermoleculares más fuertes.
Impacto en las Propiedades Químicas
La isomería geométrica también influye en las propiedades químicas de los compuestos. Por ejemplo, la reactividad en reacciones de adición puede variar entre los isómeros cis y trans. En general, los isómeros cis tienden a ser más reactivos debido a la mayor tensión estérica.
Un caso de estudio relevante es la hidrogenación catalítica de alquenos. En esta reacción, los isómeros cis suelen hidrogenarse más rápidamente que los isómeros trans debido a la configuración espacial de los átomos.
Consejo Práctico
Al trabajar con compuestos que presentan isomería cis-trans, es crucial identificar correctamente la configuración geométrica para predecir y entender sus propiedades físicas y químicas. El uso de técnicas como la espectroscopia infrarroja (IR) y la resonancia magnética nuclear (RMN) puede ser muy útil para esta tarea.
La isomería cis-trans juega un papel fundamental en la química de los compuestos con dobles enlaces, afectando tanto sus propiedades físicas como químicas y su comportamiento en reacciones específicas.
Preguntas frecuentes
¿Qué es un doble enlace entre carbonos?
Un doble enlace entre carbonos es una conexión química en la que dos átomos de carbono comparten dos pares de electrones, lo que les confiere propiedades particulares.
¿Cómo afecta un doble enlace al comportamiento químico de un compuesto?
Los compuestos con doble enlace entre carbonos suelen ser más reactivos que aquellos con enlaces simples, participando en reacciones de adición, oxidación y polimerización.
¿Cuál es la geometría de un doble enlace entre carbonos?
La geometría más común en un doble enlace entre carbonos es la planar, lo que le otorga rigidez a la molécula y limita su capacidad de rotación.
¿Cuáles son algunos ejemplos de compuestos con doble enlace entre carbonos?
Algunos ejemplos comunes son el eteno (C2H4), propeno (C3H6) y butadieno (C4H6), utilizados en la industria química y como materias primas en la fabricación de plásticos y fibras sintéticas.
¿Cómo se puede identificar la presencia de un doble enlace entre carbonos en un compuesto?
La espectroscopia infrarroja y la resonancia magnética nuclear son técnicas comunes para identificar la presencia de un doble enlace entre carbonos en una molécula.
¿Qué propiedades físicas presentan los compuestos con doble enlace entre carbonos?
Los compuestos con doble enlace entre carbonos suelen tener puntos de ebullición más bajos que sus homólogos con enlaces simples, debido a interacciones intermoleculares más débiles.
| Aspectos clave sobre compuestos con doble enlace entre carbonos |
|---|
| Mayor reactividad en comparación con enlaces simples |
| Geometría planar que limita la rotación |
| Utilizados en la fabricación de plásticos y fibras sintéticas |
| Se pueden identificar mediante espectroscopia infrarroja y resonancia magnética nuclear |
| Puntos de ebullición más bajos que compuestos con enlaces simples |
¿Tienes más preguntas sobre el comportamiento químico de compuestos con doble enlace entre carbonos? ¡Déjalas en los comentarios y revisa nuestros otros artículos para seguir aprendiendo!