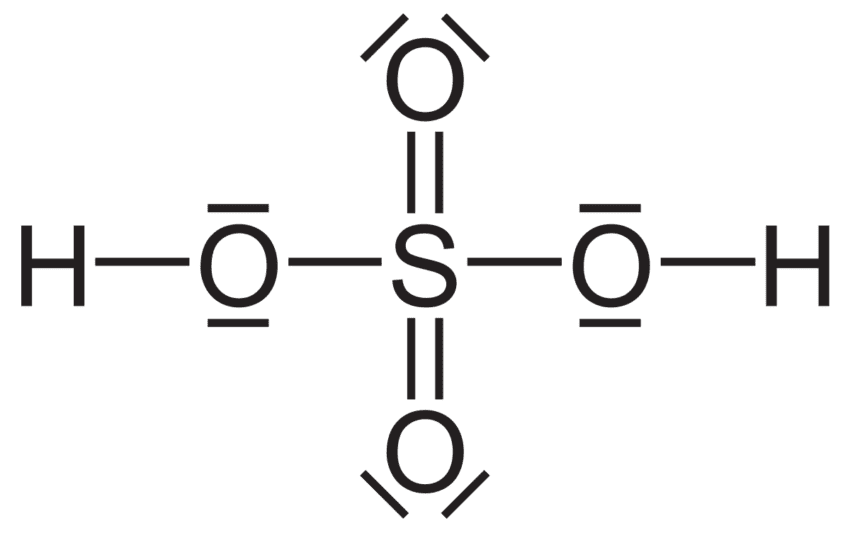
✅ Para calcular la masa molecular del ácido sulfúrico (H₂SO₄), suma las masas atómicas: 2H (1), 1S (32), y 4O (16). Resultado: 98 g/mol.
Calcular la masa molecular del ácido sulfúrico es un proceso sencillo que requiere conocer las masas atómicas de los elementos que forman parte de su fórmula química. El ácido sulfúrico, con la fórmula H2SO4, está compuesto por hidrógeno (H), azufre (S) y oxígeno (O).
Para calcular la masa molecular del ácido sulfúrico, primero debemos identificar las masas atómicas de cada uno de los elementos presentes:
- Hidrógeno (H): 1.01 g/mol
- Azufre (S): 32.07 g/mol
- Oxígeno (O): 16.00 g/mol
La fórmula química del ácido sulfúrico indica que cada molécula contiene:
- 2 átomos de hidrógeno (H)
- 1 átomo de azufre (S)
- 4 átomos de oxígeno (O)
Paso a paso para calcular la masa molecular del ácido sulfúrico
El cálculo se realiza sumando las masas atómicas de todos los átomos presentes en la molécula:
- Masa total del hidrógeno: 2 átomos de H × 1.01 g/mol = 2.02 g/mol
- Masa total del azufre: 1 átomo de S × 32.07 g/mol = 32.07 g/mol
- Masa total del oxígeno: 4 átomos de O × 16.00 g/mol = 64.00 g/mol
Sumando estas masas, obtenemos la masa molecular del ácido sulfúrico:
Masa molecular del H2SO4 = 2.02 g/mol + 32.07 g/mol + 64.00 g/mol = 98.09 g/mol
Importancia de saber la masa molecular
Conocer la masa molecular del ácido sulfúrico es crucial en diversas aplicaciones, desde cálculos estequiométricos en reacciones químicas hasta en la industria química y la educación. Es una herramienta fundamental para cualquier químico, ingeniero o estudiante que trabaje con este compuesto.
La masa molecular también permite determinar la cantidad de sustancia en moles a partir de una masa dada, facilitando el diseño y análisis de procesos químicos. A continuación, exploraremos más aplicaciones y ejemplos prácticos de cómo utilizar este valor en contextos reales.
Entendiendo la fórmula química del ácido sulfúrico
Para calcular la masa molecular del ácido sulfúrico (H2SO4), primero debemos entender su fórmula química. El ácido sulfúrico está compuesto por hidrógeno (H), azufre (S) y oxígeno (O).
La fórmula H2SO4 nos dice que en una molécula de ácido sulfúrico hay:
- 2 átomos de hidrógeno (H)
- 1 átomo de azufre (S)
- 4 átomos de oxígeno (O)
Pesos atómicos de los elementos
Para calcular la masa molecular del ácido sulfúrico, necesitamos conocer los pesos atómicos de cada elemento:
| Elemento | Símbolo | Peso atómico (u) |
|---|---|---|
| Hidrógeno | H | 1 |
| Azufre | S | 32 |
| Oxígeno | O | 16 |
Cálculo paso a paso
Ahora, sumemos las masas atómicas de cada elemento según la fórmula H2SO4:
- Hidrógeno (H): 2 átomos x 1 u = 2 u
- Azufre (S): 1 átomo x 32 u = 32 u
- Oxígeno (O): 4 átomos x 16 u = 64 u
Finalmente, sumamos las masas parciales para obtener la masa molecular del ácido sulfúrico:
Masa molecular del ácido sulfúrico = 2 u (H) + 32 u (S) + 64 u (O) = 98 u
Ejemplo de aplicación práctica
Supongamos que en un laboratorio necesitamos preparar una solución de ácido sulfúrico con una concentración específica. Conocer la masa molecular del ácido sulfúrico nos permite calcular la cantidad exacta que debemos disolver en agua para obtener la solución deseada.
Por ejemplo, si necesitamos preparar 1 litro de una solución 1 M (molar) de ácido sulfúrico, debemos disolver 98 gramos de H2SO4 en agua hasta completar el litro, ya que la molaridad se define como el número de moles de soluto por litro de solución.
Ejemplos prácticos de cálculo de masa molecular
Para entender mejor cómo calcular la masa molecular del ácido sulfúrico (H2SO4), veamos algunos ejemplos prácticos. Este enfoque no solo te permitirá dominar los conceptos, sino también aplicar estos conocimientos en situaciones reales.
Paso 1: Identificar los elementos y sus cantidades
El primer paso es identificar los elementos que componen el ácido sulfúrico y la cantidad de átomos de cada elemento en una molécula. La fórmula H2SO4 indica que hay:
- 2 átomos de Hidrógeno (H)
- 1 átomo de Azufre (S)
- 4 átomos de Oxígeno (O)
Paso 2: Conocer las masas atómicas
Para calcular la masa molecular, necesitamos saber las masas atómicas de los elementos involucrados. Estas se encuentran en la tabla periódica:
- Masa atómica del Hidrógeno (H): 1.01 g/mol
- Masa atómica del Azufre (S): 32.06 g/mol
- Masa atómica del Oxígeno (O): 16.00 g/mol
Paso 3: Multiplicar las masas atómicas por el número de átomos
Ahora multiplicamos la masa atómica de cada elemento por la cantidad de átomos en la molécula:
- Hidrógeno: 2 átomos x 1.01 g/mol = 2.02 g/mol
- Azufre: 1 átomo x 32.06 g/mol = 32.06 g/mol
- Oxígeno: 4 átomos x 16.00 g/mol = 64.00 g/mol
Paso 4: Sumar las masas atómicas totales
Finalmente, sumamos las masas atómicas para obtener la masa molecular total del ácido sulfúrico:
Masa molecular de H2SO4 = 2.02 g/mol + 32.06 g/mol + 64.00 g/mol = 98.08 g/mol
Ejemplo adicional
Supongamos que quieres calcular la masa molecular de otro compuesto, como el agua (H2O). Sigamos el mismo proceso:
- Identificar los elementos y sus cantidades:
- 2 átomos de Hidrógeno (H)
- 1 átomo de Oxígeno (O)
- Conocer las masas atómicas:
- Hidrógeno (H): 1.01 g/mol
- Oxígeno (O): 16.00 g/mol
- Multiplicar las masas atómicas por el número de átomos:
- Hidrógeno: 2 x 1.01 g/mol = 2.02 g/mol
- Oxígeno: 1 x 16.00 g/mol = 16.00 g/mol
- Sumar las masas atómicas totales:
- Masa molecular del agua (H2O): 2.02 g/mol + 16.00 g/mol = 18.02 g/mol
Consejos prácticos
Para facilitar el cálculo de la masa molecular, aquí tienes algunos consejos útiles:
- Utiliza una calculadora científica para asegurarte de que los cálculos sean precisos.
- Siempre verifica las masas atómicas en una tabla periódica actualizada.
- Practica con diferentes compuestos para afianzar tus conocimientos.
Preguntas frecuentes
¿Qué es la masa molecular del ácido sulfúrico?
La masa molecular del ácido sulfúrico es la suma de las masas atómicas de todos los átomos que componen una molécula de ácido sulfúrico.
¿Cómo se calcula la masa molecular del ácido sulfúrico?
Para calcular la masa molecular del ácido sulfúrico, se suman las masas atómicas de los átomos de azufre, oxígeno e hidrógeno presentes en la fórmula química H2SO4.
¿Cuál es la fórmula química del ácido sulfúrico?
La fórmula química del ácido sulfúrico es H2SO4, lo que indica que cada molécula contiene 2 átomos de hidrógeno, 1 átomo de azufre y 4 átomos de oxígeno.
¿Para qué se utiliza el ácido sulfúrico en la industria?
El ácido sulfúrico se utiliza en la industria para la fabricación de fertilizantes, detergentes, productos químicos, baterías, entre otros.
¿Es peligroso manipular ácido sulfúrico sin protección?
Sí, el ácido sulfúrico es altamente corrosivo y puede causar quemaduras graves en la piel y daños en los ojos si se manipula sin la protección adecuada.
¿Cuál es la masa molar del ácido sulfúrico?
La masa molar del ácido sulfúrico es aproximadamente 98.08 g/mol.
| Puntos clave sobre el ácido sulfúrico |
|---|
| El ácido sulfúrico es un compuesto químico altamente corrosivo. |
| Se utiliza en la industria para diversas aplicaciones, como la fabricación de productos químicos y baterías. |
| Su fórmula química es H2SO4, lo que indica la presencia de átomos de hidrógeno, azufre y oxígeno. |
| La masa molar del ácido sulfúrico es de aproximadamente 98.08 g/mol. |
| Es importante manipularlo con precaución y siguiendo las medidas de seguridad adecuadas. |
¡Déjanos tus comentarios y no olvides revisar otros artículos relacionados con la química en nuestra página!